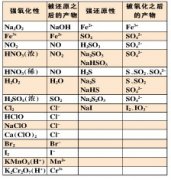
高中化学离子方程式总结
在离子反应中,反应物之间物质的量的相对大小有时候决定反应的实质、产物的种类和存在形式,所以,我们一定要仔细辨析这些反应,才能找到恰当的方法突破难点。
一、碱与酸酐的反应
多酸的酸酐与碱反应,酸酐少量生成正盐,酸酐过量生成酸式盐。
1、CO2与NaO
少量CO2:CO2+2OH-==CO32-+H2O
过量CO2:CO2+OH-==HCO3-
此外,当CO2通入NaAlO2、Ca(ClO)2、Na2SiO3等溶液中时,CO2少量生成碳酸盐,过量生成碳酸氢盐。不过有一个例外,当CO2通入苯酚钠溶液中,无论CO2少量还是过量,均生成碳酸氢钠,苯酚的酸性强于碳酸氢钠酸性的缘故。
类似的还有:SO2、H2S等通入到碱液中。
二、氢氧化铝的两性
2、AlCl3与NaOH
少量NaOH:Al3++3OH-==Al(OH)3↓
过量NaOH:Al3++4OH-==AlO2-+2H2O
3、NaAlO2与HCl
少量HCl:AlO2-+H++H2O==Al(OH)3↓
过量HCl:AlO2-+4H+==Al3++2H2O
所以,以NaAlO2或AlCl3为原料制备Al(OH)3沉淀,一定控制好酸碱的用量。
三、酸式盐与碱
4、NaHSO4和Ba(OH)2
溶液呈中性:2H++SO42-+Ba2++2OH-==2H2O+BaSO4↓
SO42-沉淀完全++SO42-+Ba2++OH-==H2O+BaSO4↓
5、NaHCO3和Ca(OH)2
石灰水少量:Ca2++2OH-+2HCO3-==CaCO3↓+CO32-+2H2O
石灰水过量:Ca2++OH-+HCO3-==CaCO3↓+H2O
6、Ca(HCO3)2和Ca(OH)2
石灰水少量或过量:Ca2++OH-+HCO3-==CaCO3↓+H2O
7、Mg(HCO3)2和NaOH
NaOH少量:Mg2++2OH-==Mg(OH)2↓
NaOH过量:Mg2++2HCO3-+4OH-==Mg(OH)2↓+2CO32-+2H2O
方法:少量物质定为1,且符合组成关系,过量物质需要多少写多少。
四、复盐与碱
8、KAl(SO4)2和Ba(OH)2
沉淀的物质的量最大(Al3+沉淀完全):
2Al3++3Ba2++3SO42-+6OH-==2Al(OH)3↓+3BaSO4↓
沉淀的质量最大(SO42-沉淀完全):
Al3++2Ba2++2SO42-+4OH-==AlO2-+2BaSO4↓+2H2O
KAl(SO4)2和Ba(OH)21:1反应
2Al3++3Ba2++3SO42-+6OH-==2Al(OH)3↓+3BaSO4↓
方法:先确定反应物物质的量之比,再根据离子的反应实质确定参加反应的离子的物质的量关系。
五、氧化还原顺序问题
一种还原剂遇到多种氧化剂,先和氧化性强的物质反应;一种氧化剂遇到多种还原剂,先和还原性强的物质反应。
9、FeBr2溶液中通入Cl2(Fe2+比Br-还原性强)
少量Cl2:2Fe2++Cl2==2Fe3++2Cl-
过量Cl2:2Fe2++Br-+3Cl2==2Fe3++2Br2+6Cl-
50%Br—被氧化:2Fe2++2Br-+2Cl2==2Fe3++Br2+4Cl-
FeI2溶液中通入少量Cl2(I-比Fe2+还原性强)2I-+Cl2==I2+2Cl-
10、FeCl3和Zn
少量Zn:2Fe3++Zn==2Fe2++Zn2+
过量Zn:2Fe3++3Zn==2Fe+3Zn2+
小结:
离子方程式中量不同而面目不同多有存在,百变不离其宗,抓住基本方法,书写就能快速准确:
1、酸式盐与碱反应,少量物质定为1(阴阳离子参加反应,计量系数必须符合组成关系),多量物质需要多少写多少。
2、如果有不同的要求,根据题意定出反应物的物质的量之比,再研究离子之间的反应实质。
随机阅读
- [高考化学备考] 怎样掌握高中化学学习方法
- [高考化学备考] 化学解决计算题失分的步骤
- [高考化学备考] 高考化学知识点:常见的氧
- [高考化学备考] 高中化学学习中总结的四个
- [高考化学备考] 高三化学知识点 化学反应
- [高考化学备考] 高考化学复习指导:轻重分
- [高考化学备考] 高考化学知识点:带颜色的
- [高考化学备考] 怎样做化学元素推断题
- [高考化学备考] 理综化学大题高分技巧
- [高考化学备考] 高中化学离子方程式判断
- [高考化学备考] 高中化学方程式总结
- [高考化学备考] 高考化学学习防范:化学知
- [高考化学备考] 高中化学易错知识点
- [高考化学备考] 高考化学复习方法: 改变
- [高考化学备考] 高三化学知识点 电解质
- [高考化学备考] 化学教学中渗透绿色化学教